Молодой ученый Южно-Уральского государственного университета Геннадий Макаров совместно с Московским государственным университетом им. М. В. Ломоносова исследует бактериальную рибосому. Результаты найдут применение при создании нового антибиотика, способного преодолевать защитные системы бактерий. Проект реализуется в рамках гранта РНФ.
Бактерий, устойчивых к антибиотикам, становится больше
Необходимость данного исследования заключается в том, что уже существующие антибиотики часто не действуют на пациентов в связи с тем, что бактерии мутировали и стали устойчивыми к их действию. Новые, полностью синтетические антибиотики могли бы быть активными против таких устойчивых патогенов, однако в настоящее время их еще не разрабатывали.
«Дело в том, что половина семейств антибиотиков действует на рибосому бактериальной клетки. Рибосомы — это органеллы клетки, огромные комплексы белков и РНК, отвечающие за синтез белков. Антибиотики являются "столпом" нашего качества жизни, и именно благодаря антибактериальным препаратам для нас не представляет неразрешимой проблемы бактериальная инфекция. Золотая эпоха антибиотиков пришлась на 1950‒60 годы, когда новые препараты очень быстро вводились в медицинскую практику и позволяли добиваться значительных результатов. Однако уже в 1980 годы в мире интенсивно распространяются устойчивые штаммы бактерий, и антибиотики перестают действовать. Мы стремимся разобраться в механизмах действия бактериальной рибосомы и на основании полученных данных понять, как должны выглядеть новые антибиотики», — рассказывает старший научный сотрудник НИЛ «Многомасштабное моделирование многокомпонентных функциональных материалов» ЮУрГУ, кандидат химических наук Геннадий Макаров.
Каким должен быть новый антибиотик?
Одна из важных проблем заключается в том, что бактерии постоянно имеют возможность мутировать и приобретать устойчивость к лекарственным препаратам. Так, больницы являются тем пространством, в условиях которого разнообразные патогенные бактерии постоянно соприкасаются с антибиотиками. Их дозы недостаточны, чтобы уничтожить бактерии, но достаточны, чтобы отбирать бактерии, устойчивые к применяемым лекарственным препаратам. И человек, заразившись каким-либо инфекционным заболеванием, вызываемым такими устойчивыми бактериями, не сможет лечиться антибиотиками.
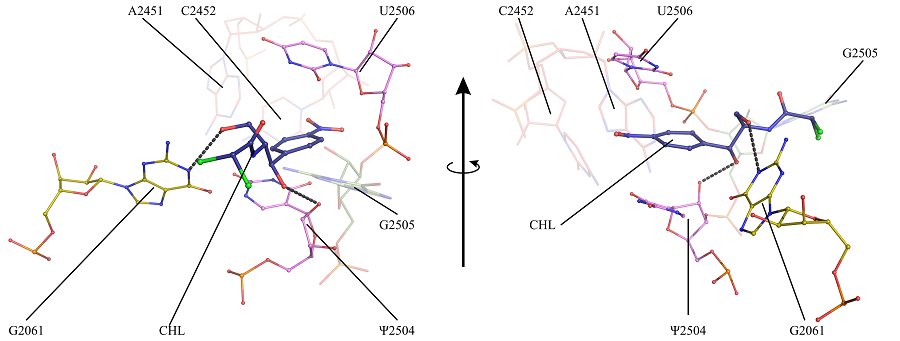
Структура неканонического комплекса хлорамфеникола с рибосомой E. coli (кишечная палочка)
Другая проблема заключается в том, что поиск новых антибактериальных лекарственных средств затруднен, так как учеными уже найдено большое количество природных антибиотиков. И обнаружение еще одного природного антибиотика не станет решением по той причине, что у бактерий с высокой вероятностью уже существует система защиты против его действия. В связи с этим возникает необходимость в создании полностью искусственных, синтетических антибиотиков, к которым бактерии долгое время не смогут адаптироваться.
«Антимикробный эффект антибиотиков обусловлен нарушением синтеза белка в бактериальных рибосомах, и новый синтетический антибиотик будет создан на основе знаний о структуре рибосомы. Получив его, мы должны будем ввести его в медицинскую практику и прекратить применение старых антибиотиков. Их использование снова станет возможным через 50‒100 лет, когда перестанут циркулировать устойчивые к ним штаммы бактерий», — отмечает Геннадий Макаров.
Неработоспособность антибиотиков часто связана с тем, они не могут проникнуть в бактериальную клетку. Так, болезнетворные бактерии образуют защитную пленку и сопротивляются ультрафиолетовому излучению, не поддаются дезинфицирующим реагентам. Новый антибиотик должен будет обходить существующие механизмы устойчивости и часто встречающиеся мутации бактерий. Он должен обладать высокой проницаемостью, которая позволила бы бороться с туберкулезом и другими опасными инфекционными заболеваниями.






